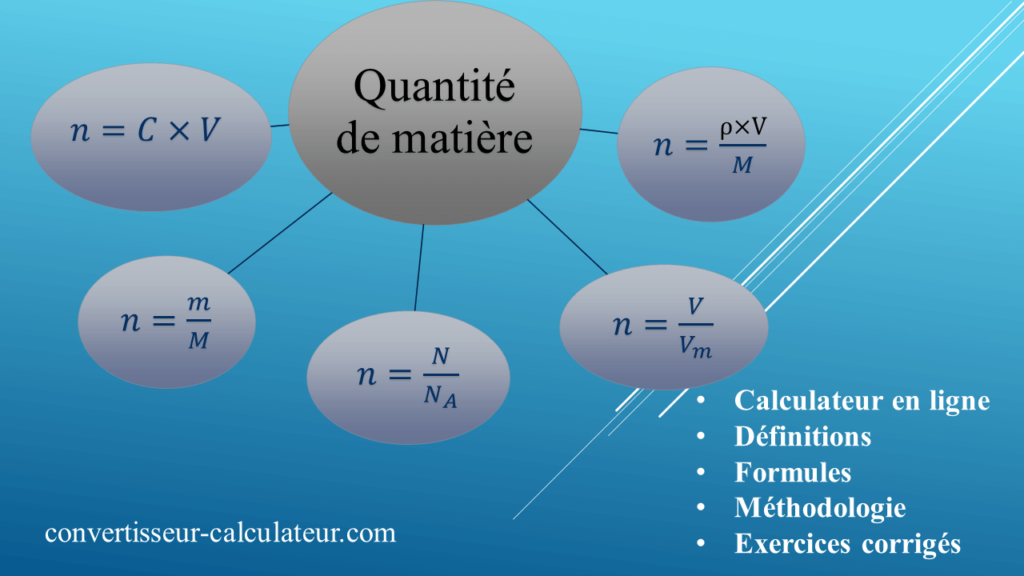
La quantité de matière : Calcul en ligne, définition, formules, Méthodologie et exercices corrigés
Calcul de la quantité de matière
Définition de la quantité de matière
La quantité de matière d’un solide, liquide ou gaz se note « n ». C’est une grandeur physique qui s’exprime en mole de symbole « mol ».
La mole
Unité utilisée pour indiquer une quantité de matière. Une mole correspond au nombre d’atomes contenus dans 12 g de carbone 12. Une mole permet donc de dénombrer une grande quantité d’atomes, de molécules, d’ions …
Nombre d’Avogadro
Le nombre d’entités présentes dans une mole est une constante appelée le nombre d’Avogadro. On la note : NA
Son unité est mol-1. Sa valeur est : NA = 6,02.1023 mol-1.
NA = 602 000 000 000 000 000 000 000 mol-1 = 602 000 milliards de milliards d’entités par mole.
Grâce à cette constante on peut passer facilement de l’infiniment petit, à des quantités de matière plus faciles à évaluer et à mesurer.
Comment calculer la quantité de matière ?
Le calcul d’une quantité de matière sera différent selon que l’espèce étudiée est solide, liquide, dissoute dans une solution ou encore, gazeuse.
1) A partir du nombre d’Avogadro
Le changement d’unité entre le nombre d’entités N d’un échantillon et le nombre de moles, se fait par l’intermédiaire du nombre d’Avogadro NA selon la formule suivante :
n = N/ NA
Avec :
- n : quantité de matière en mole (mol).
- N : nombre d’entités
- NA : constante d’Avogadro en mol-1.
Exemple :
On considère un échantillon de graphite (carbone solide) de quantité de matière n = 3, 5 mol. A quel nombre d’atomes de carbone cela correspond-il ?
On sait que n = N/NA. Or on connait n et on cherche N donc :
N = n × NA
N = 3, 5 × 6, 02.1023
N = 2, 1.1024 atomes de carbone.
2) A partir de la masse d’un produit :
Pour un solide on utilise la formule :
n = m/M
Avec :
- n : Quantité de matière en moles (mol).
- m : Masse de l’échantillon, s’exprime en grammes (g).
- M : Masse molaire de l’espèce chimique, s’exprime en grammes par mole (g.mol–1).
3) A partir du volume d’un liquide :
De la formule de la masse volumique, on en tire que m = ρ×V
On insère cette expression dans la formule précédente d’où :
n = ρ×V /M
Avec :
- n : Quantité de matière en moles (mol).
- ρ : masse volumique, s’exprime en grammes par litre (g.L–1).
- V : le volume du liquide, s’exprime en litres (L).
- M : Masse molaire de l’espèce chimique, s’exprime en grammes par mole (g.mol–1).
4) A partir de la concentration molaire :
Pour une espèce dissoute en solution :
n = C × V
Avec :
- n : Quantité de matière en moles (mol).
- C : la concentration, s’exprime en moles par litre (mol.L–1).
- V : le volume s’exprime en litres (L).
5) Pour un gaz
n = V / Vm
Avec :
- n : Quantité de matière en moles (mol).
- Vm : le volume molaire, s’exprime en litres par mole (L.mol–1).
- V : le volume de gaz, s’exprime en litres (L).
Le volume molaire est le même pour tous les gaz dits « parfaits ». Il dépend cependant de la température et de la pression. À une température de 20 °C et à une pression de 1 013 hPa, Vm = 24,0 L.mol–1.
Méthodologie
Pour calculer une quantité de matière, il faut donc :
1. Identifier l’état de l’espèce chimique : solide, liquide, dissout dans une solution ou gazeux.
2. Sélectionner la formule adéquate parmi celles données ci-avant.
3. Vérifier que toutes les grandeurs nécessaires au calcul de la quantité de matière sont données dans l’énoncé. Si ce n’est pas le cas, calculer ces grandeurs (masse molaire par exemple) par ailleurs.
4. Appliquer la formule en respectant les unités.
5. Exprimer le résultat correctement.
Exercices corrigés sur la quantité de matière
Exercice N°1 :
Déterminer les quantités de matière correspondant aux nombres d’entités microscopiques suivants.
a. 6,02 x 1023
b. 3,01 x 1023
c. 1,806 x 1024 ;
Solution
On applique la relation n= N/NA avec NA = 6,02.1023 mol-1.
a. 6,02 x 1023 ==> n = 1 mol
b. 3,01 x 1023 ==> n = 0.5 mol
c. 1,806 x 1024 ==> n = 3 mol
Exercice N°2 :
La créatine rend les muscles plus efficaces en effort intense et rapide. Sa vente est légale en France, mais sa consommation ne doit pas excéder une masse m = 3,0 g par jour.
Quelle quantité de matière n de créatine C4H9 N3O2 est-on autorisé à consommer quotidiennement ?
Donnée : masse molaire de la créatine, M = 131 g.mol-l.
Solution
n = m/M = 3,0 / 131 = 0,023 mol = 2,3 x 10-2 mol (= 23 mmol)
remarque : M(créatine) = 4MC + 9MH + 3MN + 2MO = 4 x 12,0 + 9 x 1,0 + 3 x 14,0 + 2 x 16,0 = 131 g.mol-1.
Exercice N°3 :
Quelle est la quantité de matière n de soluté dans un volume V = 0,50 L d’une solution aqueuse d’éthanol de concentration molaire C = 5,0 x 10-2 mol.L-1 ?
Solution
C = n/V donc n = C.V = 5,0 x 10-2 x 0,50 = 2,5 x 10-2 mol.
Exercice N°4 :
L’éthoxyéthane C4H10O, couramment appelé éther, est souvent utilisé comme solvant, et anciennement comme anesthésique général.
a. Quelle est la masse m d’éther dans un flacon de volume V = 100 mL vendu en pharmacie ?
ρ = m/V donc m = ρ.V = 0,70 x 0,100 = 0,070 kg = 70 g
b. Quelle est la quantité de matière n d’éther dans ce flacon ?
Donnée : masse volumique de l’éther : ρ = 0,70 kg.L-1
n =m / M(éther)
avec M(éther)= 4MC + 10MH + MO = 4 x12,0+ 10 x1,0+ 16,0= 74,0 g.mol-1
donc: n= 70/74, 0 = 0,95 mol
Exercice N°4 :
On prépare un volume V = 0,200 L d’une eau iodée en dissolvant une quantité de matière n = 2,0 x 10-4 mol de diode dans de l’eau. Calculer la concentration molaire C, puis la concentration massique Cm de cette eau iodée.
Solution
C = n/V = 2,0×10-4 /0,200 = 1,0 x 10-3 mol.L-1 (= 1,0 mmol.L-1) ; Cm = C x M(diode)
diode de formule I2 donc M(diode) = 2MI= 2x 127,0 = 254,0 g.mol-1 et Cm= 0,254 g.L-1